Vorhofflimmern bei Herzinsuffizienz: Katheterablation besser als Medikamente
Eine Katheterablation führt bei Patienten mit Vorhofflimmern und Herzinsuffizienz zu wesentlich besseren Ergebnissen als eine medikamentöse Frequenz- oder Rhythmuskontrolle. Das zeigt die CASTLE-AF-Studie.1
Wenn zu einer Herzinsuffizienz auch noch ein Vorhofflimmern (VHF) hinzukommt, steigt die Morbidität und Mortalität der Betroffenen an.1 Lange Zeit galt die Katheterablation für nur wenige VHF-Patienten als alternative Behandlungsmethode. Heute jedoch ist sie eine etablierte Therapieoption des VHF bei symptomatischen Patienten. Einen großen Einfluss auf diese Entwicklung, die ihren Niederschlag auch kürzlich in der neuen Praxisleitlinie der Europäischen Gesellschaft für Kardiologie (ESC) zur Diagnostik und Therapie von Vorhofflimmern gefunden hat, hatte die CASTLE-AF-Studie aus dem Jahr 2018.2
Diese Studie untersuchte, ob eine Katheterablation des VHF bei Patienten mit zusätzlicher Herzinsuffizienz harte Endpunkte wie Mortalität beziehungsweise Klinikaufenthalte aufgrund einer Progression der Herzinsuffizienz gegenüber der konventionellen Standardtherapie verbessern kann.1
Patientenmerkmale: VHF, NYHA-Stadien 2–4, implantierter Defibrillator
An der Studie nahmen Patienten mit symptomatischem paroxysmalem oder persistierendem VHF teil, die auf Antiarrhythmika nicht ansprachen, diese nicht tolerierten oder die die Einnahme von Antiarrhythmika ablehnten.
Zur Behandlung des VHF wurden die Studienteilnehmer wie folgt randomisiert:1
- Katheterablation: 179 Patienten
- medikamentöse Therapie (Frequenz- oder Rhythmuskontrolle): 184 Patienten
Zusätzlich erfolgte eine leitlinienkonforme Therapie der Herzinsuffizienz.
Bei allen Patienten lag eine Herzinsuffizienz der NYHA-Stadien 2, 3 oder 4 (NYHA = New York Heart Association) sowie eine linksventrikuläre Ejektionsfraktion von höchstens 35 % vor. Alle Patienten trugen einen implantierten Defibrillator (ICD oder CRT-D).
Der primäre Endpunkt war ein kombinierter Endpunkt aus Tod jeglicher Ursache oder Hospitalisierung wegen progredienter Herzinsuffizienz.1
Signifikant weniger Todesfälle und Klinikeinweisungen nach Ablation
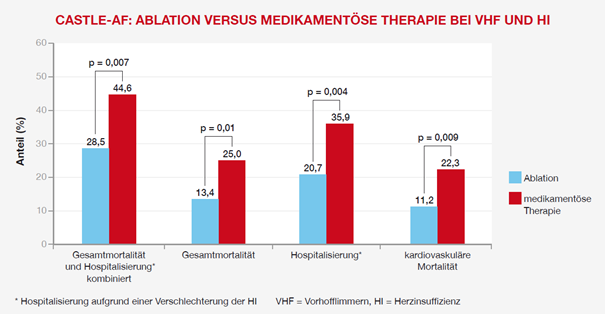
Das Ergebnis der CASTLE-AF-Studie war eindeutig. Nach einer medianen Nachbeobachtungszeit von 37,8 Monaten trat der primäre Endpunkt
- in der Ablationsgruppe nur bei 51 Patienten (28,5 %),
- in der Medikamentengruppe dagegen bei 82 Patienten (44,6 %) ein.1
In beiden Komponenten des primären Endpunktes führte die Katheterablation zu wesentlich besseren Ergebnissen als die medikamentöse Therapie:1
- In der Ablationsgruppe starben insgesamt signifikant weniger Teilnehmer (Gesamtmortalität: 24 vs. 46 Patienten [13,4 % vs. 25,0 %]; Hazard Ratio [HR] = 0,53, 95-%-Konfidenzintervall [KI] 0,32–0,86; p = 0,01).1
- Es mussten signifikant weniger Patienten wegen einer Verschlechterung der Herzinsuffizienz stationär eingewiesen werden (37 vs. 66 Patienten [20,7 % vs. 35,9 %]; HR = 0,56; 95-%-KI = 0,37–0,83, p = 0,004).1
Auch Todesfälle aus kardiovaskulärer Ursache waren in der Ablationsgruppe um etwa die Hälfte reduziert (20 vs. 41 Patienten [11,2 % vs. 22,3 %]; HR = 0,49, 95-%-KI = 0,29–0,84, p = 0,009).1
Abbildung 1: Ergebnisse der CASTLE-AF-Studie. Nach Marrouche et al. NEJM 2018.1
Generalisierbarkeit der CASTLE-AF-Studie
Die Ergebnisse der CASTLE-AF-Studie wurden in mehreren Folgestudien auf ihre Generalisierbarkeit überprüft – unter anderem anhand einer großen Kohorte mit knapp 290.000 VHF- und Herzinsuffizienzpatienten.2, 3 Diese Analyse ergab, dass nur eine kleine Anzahl von Patienten (< 10 %) die CASTLE-AF-Einschlusskriterien erfüllte. Jedoch profitierten diese Patienten signifikant von einer Katheterablation.2, 3
Fazit für die Praxis
Die neue ESC-Leitlinie2 berücksichtigt die Ergebnisse von CASTLE-AF- und anderen Studien. So sollte eine Katheterablation bei symptomatischen Patienten mit VHF und Herzinsuffizienz zur Symptomverbesserung in Erwägung gezogen werden, wenn eine Tachykardiomyopathie sehr wahrscheinlich ist (Klasse I, Level B).2 Nichtsdestotrotz sind den Autoren zufolge weitere Studien nötig, um die Auswirkungen einer Katheterablation bei VHF auf die Mortalität, das Schlaganfallrisiko, die Wahrscheinlichkeit von schweren Blutungen, ein VHF-Rezidiv und die Lebensqualität näher zu untersuchen.2
Quellen:
- Marrouche NF, Brachmann J, Andresen D et al. Catheter Ablation for Atrial Fibrillation with Heart Failure. New England Journal of Medicine 2018; 378: 417-427. https://www.nejm.org/doi/full/10.1056/NEJMoa1707855.
- Hindricks G, Potpara T, Dagres N et al. 2020 ESC Guidelines for the diagnosis and management of atrial fibrillation developed in collaboration with the European Association of Cardio-Thoracic Surgery (EACTS). Eur Heart J 2020: https://pubmed.ncbi.nlm.nih.gov/32860505/.
- Noseworthy PA, Van Houten HK et al. Generalizability of the CASTLE-AF trial: Catheter ablation for patients with atrial fibrillation and heart failure in routine practice. Heart Rhythm. 2020 Jul; 17 (7): 1057-1065. doi: 10.1016/j.hrthm.2020.02.030. Epub 2020 Mar 4. PMID: 32145348; PMCID: PMC7648571: https://pubmed.ncbi.nlm.nih.gov/29385358/.
Bildquelle: AdobeStock: #40895702; Urheber: Nuno Monteiro